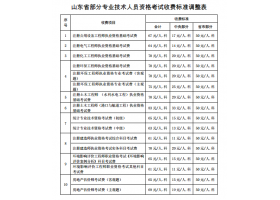
由于液体的饱和汽压随温度的改变而改变。任何一种液体只有在一定的温度下才能沸腾,液体发生沸腾还必须是它的饱和汽压与外界压强相等。当外界压强增大时,液体的饱和汽压也相应的增大。因此液体的沸点又与外界压强有关,它随外部压强的增大而升高,随外部压强的减少而降低。一般高压锅内达2个大气压时,锅内温度可达到120℃。
从宏观角度看沸腾与蒸发有所区别。但从相变机构看,沸腾与蒸发只是汽化的不同形式,并没有本质的区别,沸腾时,汽化仍在气、液分界面上以蒸发的方式进行。沸腾过程中只不过是在液体内部向上涌起大量的小汽泡,升到液面破裂而将大量蒸汽分子送出液面,加快了蒸发的速度。因此,可将沸腾看作是液体内部的汽泡界面上蒸发的过程。这样就大大地增加了气、液之间的分界面。
【沸点】液体发生沸腾时的温度。当液体沸腾时,在其内部所形成的气泡中的饱和蒸汽压必须与外界施予的压强相等,气泡才有可能长大并上升,所以,沸点也就是液体的饱和蒸汽压等于外界压强的温度。液体的沸点跟外部压强有关。当液体所受的压强增大时,它的沸点升高;压强减小时,沸点降低。例如,蒸汽锅炉里的蒸汽压强,约有几十个大气压,锅炉里的水的沸点可在200℃以上。又如,在高山上煮饭,水易沸腾,但饭不易熟。这是由于大气压随地势的升高而降低,水的沸点也随高度的升高而逐渐下降。(在海拔1900米处,大气压约为79800帕(600毫米汞柱),水的沸点是93.5℃)。
在相同的大气压下,液体不同沸点亦不相同。这是因为饱和汽压和液体种类有关。在一定的温度下,各种液体和饱和汽压亦一定。例如,乙醚在20℃时饱和气压为5865.2帕(44厘米汞柱)低于大气压,温度稍有升高,使乙醚的饱和汽压与大气压强相等,将乙醚加热到35℃即可沸腾。液体中若含有杂质,则对液体的沸点亦有影响。液体中含有溶质后它的沸点要比纯净的液体高,这是由于存在溶质后,液体分子之间的引力增加了,液体不易汽化,饱和汽压也较小。要使饱和汽压与大气压相同,必须提高沸点。不同液体在同一外界压强下,沸点不同。沸点随压强而变化的关系可由克劳修斯—克拉珀龙方程得出。
【过热】液体被加热,当温度超过其沸点时仍不沸腾的现象叫“过热”。造成这种情形的原因是液体内缺少汽化核。因为液体中的空气泡是沸腾开始时的中心。周围的水要向气泡内蒸发使其体积增大而沸腾。若液体很纯洁无杂质和空气泡,或者经较长时间沸腾后,液体中的空气已经放尽,即使将水加热到100℃以上(其他液体温度高于沸点),也可能还不沸腾。如果在过热液体中投入一些附有空气的固体微粒如玻璃碎片等,液体也会立刻沸腾起来。
【暴沸】对过热液体继续加热,会骤然而剧烈地发生沸腾现象,这种现象称为“暴沸”,或叫作“崩沸”。过热是亚稳状态。由于过热液体内部的涨落现象,某些地方具有足够高的能量的分子,可以彼此推开而形成极小的气泡。当过热的液体温度远高于沸点时,小气泡内的饱和蒸气压就比外界的压强高,于是气泡迅速增长而膨胀,以至由于破裂引起工业容器的爆炸。液体之所以发生过热的原因是液体里缺乏形成气泡的核心。为避免容器的暴沸,可在容器中放含有空气的无釉陶块等。
【汽化核】液体内部剧烈汽化过程中,器壁上吸附的小气泡与其周围的液体间进行汽化的变化,这些小气泡起着汽化中心的作用,故称作“汽化核”。见“过热”及“暴沸”条。
【蒸气】由于液态物质的汽化,或固态物质升华而形成的气态物质,称为“蒸气”。蒸气是处于临界温度以下的气体。在保持温度不变的条件下,可通过压缩办法使蒸气变成液体(液化)或固体(凝华)。
【临界状态】亦称为临界点。是物质的气态和液态能够平衡共存的一个边缘状态。当物质的饱和气的密度与它的液态的密度相等时,这时物质所处的状态叫做“临界状态”。使物质处于临界状态,必须在一定的温度和压强下才能实现。物质处于临界状态时的压强叫做临界压强,处于临界状态时的温度称为临界温度。这部分物质所占有的容积,称为临界体积。临界温度、临界压强、临界体积统称为临界参量,对于不同的物质其临界参量的数值亦不相同。
【临界点】见“临界状态”。在临界等温线上相当于临界态的一点叫临界点。
【临界压强】临界点的压强称临界压强。见“临界状态”。
【临界温度】物质处于临界状态时的温度,称为“临界温度”。降温加压,是使气体液化的条件。但只加压,不一定能使气体液化,应视当时气体是否在临界温度以下。如果气体温度超过临界温度,无论怎样增大压强,气态物质也不会液化。例如,水蒸气的临界温度为374℃,远比常温要高,因此,平常水蒸气极易冷却成水。其他如乙醚、氨、二氧化碳等,它们的临界温度高于或接近室温,这样的物质在常温下很容易被压缩成液体。但也有一些临界温度很低的物质,如氧、空气、氢、氦等都是极不容易液化的气体。其中氦的临界温度为—268℃。要使这些气体液化,必须具备一定的低温技术和设备,使它们达到它们各自的临界温度以下,而后再用增大压强的方法使其液化。
【临界常数】亦称临界参量。它是临界温度、临界压强和临界体积的统称。不同物质的常数值不同。
【饱和蒸气】蒸气跟产生它的液体处于动态平衡时,这种蒸气称为“饱和蒸气”。液体蒸发时,既有分子从液体中逸出形成蒸气,同时也有由于分子间或与器壁间相碰撞等原因而使分子又回到液体中去。当从液面逸出的分子数等于回到液体中来的分子数时,液面上蒸气的密度就不再增加了,液体也不再减少,此时的蒸气叫“饱和气”。在蒸气达到饱和状态时,液体分子仍不断地逃逸,只不过是在单位时间内从液面逃逸的分子数等于飞回液体的分子数。蒸气和液体之间达到了动态平衡,此时的蒸气才叫做饱和气。例如,在盖紧了的酒瓶子里,酒面上的蒸气都是饱和气。
【饱和蒸气压】饱和蒸气的压强。它与液体的种类、体积及温度有关。每一种液体在一定的温度下有一定的饱和气压,而不同种类液体的饱和气压却不相同。由于液体分子的内聚力越小,飞出液面的分子数就越多。为了要使飞回液体的分子数和飞出液面的分子数相等,即达到动态平衡,液面上蒸气的密度就必须大些,但是,当液面上蒸气的密度大时,它的压强也就增大了。例如,乙醚的内聚力最小,所以它的饱和蒸气压就最大。
在一定的温度下,同一种液体的饱和气压和饱和气所占的体积没有关系。因为在一定的温度下,如果饱和气的体积增大,则蒸气的密度就要变小。因此,在单位时间飞回液面的分子数就要少于飞出液面的分子数。这样,蒸气将处于未饱和状态,于是,液体又要继续蒸发,直到蒸气处于饱和状态,即达到动态平衡为止。也就是说,蒸气的体积增大时,由于继续蒸发,蒸气的质量增加了,而蒸气的密度却保持不变。反之,在一定的温度下,减小饱和气的体积时,蒸气的密度变大,单位时间内飞回液面的分子数多于飞出液面的分子数。这样一部分蒸气就开始凝结,直到恢复了原有的饱和值时才停止。总之,在一定的温度下,增大或减小饱和气的体积时,它的质量也随着增加或减少,而它的密度却保持不变,所以它的饱和气压也就保持不变。
液体的饱和气压随温度的升高而变大。由于饱和气体的压强跟它单位体积内的蒸气分子个数以及蒸气分子速度有关,在液体温度升高的时候,液体分子的平均动能变大,每秒钟飞出液面的分子数增多,因而饱和蒸气的密度变大,单位体积空间内饱和蒸气的质量也增加了。同时,由于温度的升高,蒸气分子运动的平均速度也变大,这就使饱和蒸气每秒撞击液面或容器壁的次数增多,每次撞击的作用加强。正因为这个双重关系,而使饱和气压随温度的升高而变大。





![[基础]考试通过有无证书或成绩单没?? [基础]考试通过有无证书或成绩单没??](http://down0.51hvac.com/down/file/upload/201701/11/16-51-02-43-222160.png)